Q&A
よくあるご質問
質問箱
島津ダイアグノスティクスの製品について、お客さまからお寄せいただいたご質問とその回答を掲載しています。
- 粉末培地・顆粒培地
- 分画培地・生培地
- 簡易培地
(コンパクトドライ) - 水中大腸菌・大腸菌群検査用培地(ECブルー)
- スタンプ培地
(フードスタンプ) - スタンプ培地
(クリーンスタンプ) - 簡易同定キット(IDテスト)・鑑別試験培地
- グラム染色(フェイバーG)
- アレルゲン検査
(FAテスト、FASTKIT) - 精度管理
- 器材
- その他
粉末培地・顆粒培地
XM-G寒天培地とDC培地との違いについて
XM-G寒天培地とDC培地は検出原理が異なります。
XM-G寒天は酵素基質による発色でコロニーを鑑別しております。DC培地は乳糖の発酵性で鑑別するため、アルカリ化を防ぐため、重層します。一方、XM-G寒天は重層不要です。
菌数は、XM-G寒天において損傷菌を考慮している事と、原理の違いから、通常では、XM-G寒天の方がDC培地よりも若干多くなる事があります。
90 mmシャーレに分注する培地量について教えてください。
寒天培地をシャーレに最低3 mmの厚さになるように、注ぎ入れます(例えば、直径90 mmのシャーレでは、通常18 mL~20 mLの寒天培地が必要となります)。 寒天平板を保管する場合、培養を72時間以上する場合、または培養温度が40℃を超える場合は、より多くの培地量が必要となる場合があります。(ISO 11133)
テトラチオネート培地(TT)を調製した際に、炭酸カルシウムの沈殿がでるが、問題ないか?
水に不溶性の炭酸カルシウムの沈殿が出ますが、性能に問題ありません。
培地廃棄時の滅菌時間は15分でよいでしょうか?
微生物が殺滅する温度と時間は121℃15分とされており、基本的にはこの温度と時間が中心部まで到達していることがバリデート(検証)されていれば121℃15分で問題ありません。
粉末培地をする調製時などでは過加熱を防ぐため121℃15分は守っていただく必要はありますが、廃棄時の滅菌ではその必要はありません。今回の質問である使用済み培地を廃棄するための滅菌では、弊社では121℃20分(20~30分)をお勧めしています。
また、ISO 7218では121℃30分が推奨されています。以下に滅菌時間を延長する理由を記載いたします。 オートクレーブは缶体で発生させた飽和水蒸気を加圧させ、2気圧になると温度が121℃に到達します。この際、缶体内の空気を抜き、完全に飽和蒸気に置換することが必要となります。使用済培地、特にシャーレを滅菌する場合には、専用のオートクレーブ用バッグ(以下、バッグ)やバケットに入れて滅菌されていると思います。特にバッグを使用した場合には、シャーレ内に存在している空気が抜けきれずにバッグ内に停滞することが起こります。
空気が抜けないと飽和水蒸気と置換され難くなるため、中心温度が121℃にならない可能性が出てきます。
このリスクを回避するためには、バッグ中にコップ1杯ほどの水(水道水)を入れ、バッグの口を開けたままの状態で滅菌するようにしてください。バッグに入れた水が水蒸気となりバッグ内の空気を追い出す働きをします。
また、オートクレーブにはタイムラグ(遅れ時間)が存在するため、被滅菌物の温度はパネル表示温度より遅れて到達することを考慮しなければなりません。被滅菌量が多いとタイムラグがさらに延長しますので、過度の量を入れて滅菌するのはお勧めしません(メーカーでは50%ほどとしています)。
以上、これらのことが滅菌時間を延長する理由です。
滅菌後の廃棄物処理については、各自治体の廃棄物規定に従って廃棄してください。
参考:廃棄物処理法に基づく感染性廃棄物処理マニュアル
https://www.env.go.jp/recycle/kansen-manual1.pdf
粉末・顆粒培地の廃棄方法は?
SDSをご参照の上、対象外品につきましては一般廃棄物として、培地容器はプラスチック廃棄物として、自治体の条例等に従って廃棄してください。
参考:SDS、添付文書・取扱説明書ページ カテゴリやキーワードで製品の絞り込みをすることも可能です。
未開封の使用期限はラベルに記されている期限を守るとして、開封済みの場合どのくらいを目途に使用をやめたほうがいいのでしょうか。
原則としては自家調製培地の試験時におこなう培地性能試験の結果に従ってください。
開封後の培地の品質は、保存している環境によって異なります。フタをきっちり閉めないでおくと、吸湿により急激に劣化します。その場合培地が固化したり、培地の色が変化しますので、外観で明らかな変化がみられるものは使用を中止してください。フタをきっちり締めておき、外観に変化がなければほぼ使用期限まで使用できます。 培地を購入した際は、①シール性の確認、②開封日を記録して、使用時には、③粉末の視覚的評価を実施する、を作業標準化(SOP)してください。(ISO 11133)
デゾキシコレート培地を沸騰水中で30分間煮沸しています。普段は400mL1本を加温溶解するが、2本以上の場合、煮沸時間を延ばして50分間ぐらい加温溶解しています。たまにフラスコの底に白い残渣が残る場合があるのですが、どうしてこのようなことが起こるのでしょうか?
白い残渣物の由来は不明ですが、50分の加温が過加熱となり、何らかの要因で不溶物が析出したと考えられます。沸騰水中での加熱は20~30分間とし、過加熱は避けてください。加温溶解の途中でフラスコを撹拌すると溶解性は増します。
なお、加温溶解は、沸騰水浴で問題はありませんが、水浴中の水量に注意が必要です。弊社では、熱が容器全体に伝わるので、蒸し器による加温溶解をお勧めしています。
粉末培地の調製において、溶解する水はどんなものを使えばよいですか?
培地の調製には、市販の精製水、逆浸透膜を通したRO水を使用してください。
精製水は、ガラスやポリエチレンなど阻害物質を含まない材質の密閉容器に保存して、精製後可能な限り速やかに使用してください。(ISO 11133)
イオン交換した水は、微生物を多く含む場合があります。10³cfu/mLを超えず、好ましくは10²cfu/mL未満が推奨されます。(ISO 11133)
粉末培地の秤量は、用時に行う必要がありますか?
作業効率を上げるため、秤量をオートクレーブ滅菌の前日に行うことを検討しています。
粉末および顆粒培地は、基本的に使用時に秤量してください。
これらの培地は吸湿性が高く、吸湿後の酸化による培地性能の低下や雑菌増殖の可能性があります。
発色酵素基質が含まれる場合、光による劣化も考慮が必要です。
どうしてもの場合には培地粉末が吸湿しない、直射日光に当たらないような配慮をしてください。
秤量効率を向上させるため、スティック状に分包した製品(Easy Mediumシリーズ)をおすすめいたします。
排水検査にアキュディア XM-G寒天培地 顆粒(製品コード:05632)を使用する際には重層が必要ですか?
重層は不要です。
アルカリ性ペプトン水はpH8.8±0.1に調製しコレラ菌用に用いますが、腸炎ビブリオ用にはNaCLをさらに10g/L加え、pH8.6に調製して用いると書かれています。pH8.6にする根拠は何ですか?
腸炎ビブリオの規格基準に示されるアルカリ性ペプトン水は、塩化ナトリウム20g/L、pH8.6とされています。弊社アルカリ性ペプトン水(製品コード:05206)はコレラ菌用に調整された培地ですので、規格基準に基づく腸炎ビブリオ検査には、前述の組成に補正して使用してください。
日本薬局方の無菌試験用培地はチオグリコール酸培地Ⅱですか?また、TGC培地の調製方法と保存方法について教えて下さい。
日本薬局方(第18改正)無菌試験法には、嫌気性細菌および好気性細菌の検出用として、液状チオグリコール酸培地(当社製品名:TGC培地)または、変法チオグリコール酸培地(当社製品名:チオグリコール酸培地Ⅱ)、および真菌および好気性細菌用として、ソイビーン・カゼイン・ダイジェスト培地(当社製品名:トリプトソーヤブイヨン)が収載されています。
TGC培地は、加温溶解後、適切な容器に分注し、121℃、20分間高圧蒸気滅菌します。保管は冷暗所で行ってください。使用する容器や保管上の注意点等は日本薬局方に従ってください。
アキュディア XM-G寒天培地 顆粒(製品コード:05632)は公定法に準拠している培地ですか?
XM-G寒天培地は、食品の成分規格における試験法に指定された培地ではありません。
しかしながら、食品衛生検査指針微生物編2018(2)その他の試験法、①酵素基質培地を用いた簡易・迅速試験法(185-186ページ)おいて、β-グルクロニダーゼ活性およびβ-ガラクトシダーゼ活性を指標として、大腸菌・大腸菌群を迅速かつ容易に検出できる方法として紹介されています。
自施設での評価のうえ、日常検査に有効活用できる培地です。
アキュディア 標準寒天培地 顆粒(製品コード:05618)は、厚生労働省 告示第261号にある一般細菌検査に使用する標準寒天培地に適合していますか?
同一組成で、適合しております。
参考リンク:水質基準に関する省令の規定に基づき環境大臣が定める方法(厚生労働省告示第二百六十一号)
粉末培地のボトルの材質
粉末顆粒培地が入っているボトルを廃棄しようと思いますので、材質を教えてください。
本体の部分はポリエチレン、フタに部分は2種類の材質を使っており、パッキン部分はプロピレン、周りはポリエチレンからなります。
緩衝ペプトン水(BPW)(製品コード:05131)が販売中止になっていますが、後継品は何ですか?また、何が違いますか?
アキュディア™ 緩衝ペプトン水(BPW ISO組成) 顆粒(製品コード:05121)を代替品として発売しました。ISO微生物試験規格で、BPWの組成が変更され、それに伴い国内の通知法(サルモネラ属および黄色ブドウ球菌検査法 2015年)が変更されたためです。今後は国内公定法に沿った新製品をお使いください。
BGLB培地オートクレーブ時の突沸防止法
BGLB培地オートクレーブ時の突沸防止法
現在BGLB培地を使わせて頂いているのですが、試験管に分注しオートクレーブにかけた時に突沸するようで、アルミキャップに培地が付着し、使用時に固まってアルミキャップが開きにくくなってしまいます。何か突沸を防ぐ方法はあるのでしょうか。ありましたら、教えていただきたいです。
BGLB培地調製時にダーラム管に気泡が残ってしまう
早速ですがBGLB培地の作成についてお教えください。
弊社は飲料製品の検査にBGLBを使っております。ダーラム管を入れた試験管にBGLB9mlを分注して121℃15分オートクレーブ後急冷にて使用していますが、ダーラム管の上部にわずかに気泡が残ってしまうのです。キャップを替えて作成してみたのですが同じでした。気泡を残さない様な作成方法を、教えてください。
EC培地用とサルモネラ用のインキュベーター共用について
1)E. coliについて 通常弊社では、EC培地を入れた試験管を恒温水槽にひたし、44.5℃に保っています。この試験管をインキュベーターに入れて温度を保つことでも問題ないでしょうか?
2)E. coli培養温度は44.5℃、サルモネラ培養温度は41℃です。インキュベーターを44.5℃に保ち、E. coliとサルモネラを同じインキュベーターで培養することは可能でしょうか?
1)E. coliについて 通常弊社では、EC培地を入れた試験管を恒温水槽にひたし、44.5℃に保っています。この試験管をインキュベーターに入れて温度を保つことでも問題ないでしょうか?
2)E. coli培養温度は44.5℃、サルモネラ培養温度は41℃です。インキュベーターを44.5℃に保ち、E. coliとサルモネラを同じインキュベーターで培養することは可能でしょうか?
ECはつ酵管法の基準をXM-Gで代用可能か?
XM-G寒天培地での食品規格基準にあります、(0.01g×3中EC培地法)とありますが、XM-G寒天培地においても同基準でしょうか?
試料の希釈水の使い分けと各々の特長について
試料の希釈水には生理食塩水、リン酸緩衝生理食塩水およびペプトン加生理食塩水の三種類があり、試料によって使い分けるとなっていますが、どのような違いがあり、どう使い分けるのでしょうか。
試料の希釈水には生理食塩水、リン酸緩衝生理食塩水およびペプトン加生理食塩水の三種類があり、試料によって使い分けるとなっていますが、どのような違いがあり、どう使い分けるのでしょうか。
食塩卵寒天培地上の白いコロニー
「食塩卵寒天基礎培地」に卵黄液を添加し、黄色ブドウ球菌の検査を行っています。 この培地に時々、白いコロニー(黄色ブドウ球菌判定基準のハローはありません)が出現するのですが、この培地ではどのような菌が反応するのでしょうか?
「食塩卵寒天基礎培地」に卵黄液を添加し、黄色ブドウ球菌の検査を行っています。 この培地に時々、白いコロニー(黄色ブドウ球菌判定基準のハローはありません)が出現するのですが、この培地ではどのような菌が反応するのでしょうか?
BCP加プレートカウントアガールによる乳酸菌の判定(1)
乳酸菌の測定にBCP加寒天培地を使わせていただきました。
混釈、重層し微好気性条件下、35℃で培養したところ、24時間後に黄変したコロニーが観察されました。取説の72時間という培養時間よりかなり早く生育しているように思われます。
これは乳酸菌なのでしょうか。乳酸菌以外の菌も同じような黄変した集落を形成するのでしょうか。また、それはどういった菌なのでしょうか。
DHL寒天培地とMLCB寒天培地の特徴と相違点
サルモネラ属菌の判定に使用する培地としてDHL寒天培地とMLCB寒天培地がありますが、両者の特徴と違いを教えてください。
55℃保温後のデゾキシコレート培地が分注時に固まってしまう
デゾキシコレート培地の調製についての質問です。
培地を加温溶解して、55℃に保温して使用しているのですが、培地を分注している最中にどんどん固まってきて塊が出来てしまいます。
ちなみに加温溶解は電子レンジで加熱しています。電子レンジで溶かしているのが原因なのでしょうか?回答よろしくお願いします。
NGKG寒天は35℃培養可能か
NGKG寒天培地の培養する温度ですが、使用していますインキュベーターが1台で35℃の設定で使用しています。35℃設定でも大丈夫でしょうか?
初歩的な質問で申し訳ありませんが、ご回答宜しお願いいたします。
SCD培地よりも栄養分に富む培地
SCDより栄養分に富むとされる培地はありますか?LB培地、ハートインフュージョン培地などでしょうか?環境検査でSCDと併せて曝露させSCDで検出されない菌を検出したいとの要求があり苦慮しているところです。
SCDより栄養分に富むとされる培地はありますか?LB培地、ハートインフュージョン培地などでしょうか?環境検査でSCDと併せて曝露させSCDで検出されない菌を検出したいとの要求があり苦慮しているところです。
TGC培地とチオグリコール酸培地Ⅱの相違点
販売されているTGC培地とチオグリコール酸培地Ⅱの相違点を知りたいのですが、よろしくお願いします。
TGSE寒天とX-SA寒天の相違点
TGSE寒天とX-SA寒天の相違点
黄色ブドウ球菌用フードスタンプTGSE寒天とX-SA寒天は具体的にどのような違いがあるのでしょうか?
TSI、LIMのサルモネラ判定について
サルモネラの判定について TSI培地及びLIM培地での検査で陽性と思われる結果が出ました。初めての陽性反応のため確認をお願いしたいです。
サルモネラの判定について TSI培地及びLIM培地での検査で陽性と思われる結果が出ました。初めての陽性反応のため確認をお願いしたいです。
X-SAL寒天培地について
硫化水素生産性サルモネラと非生産性サルモネラの違いを説明して下さい。
X-SA寒天培地の判定方法、従来培地との相関
1. X-SAに陽性限界について、この色まで陽性のような基準はありますか?
2. 発色酵素基質は具体的にはどんな基質が何の酵素と反応して発色するのかは公開されていますか?
3. マンニット食塩寒天培地とX-SAの相関のデータはありますか?
1. X-SAに陽性限界について、この色まで陽性のような基準はありますか?
2. 発色酵素基質は具体的にはどんな基質が何の酵素と反応して発色するのかは公開されていますか?
3. マンニット食塩寒天培地とX-SAの相関のデータはありますか?
X-SA寒天培地上に発育した青色コロニーの判定方法
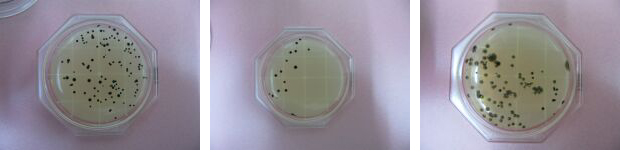
さて、今回ご相談させて頂きたい件が御座いまして、ご連絡させて頂きました。 先週末から、X-SA寒天培地の使用を本格的に実施しておりますが、扱い慣れていない酵素基質培地の特性や、判定基準について戸惑いを感じております。是非、判定方法について助言を頂きたいと思いまして、ご連絡致しました。 添付した写真は、27日に製品検査を実施し、正午頃(12時)から、孵卵器内にて24時間培養を行い、28日の正午頃(12時)に確認した、3検体分・3種類のシャーレ画像です。 X-SAの作製手順に従い、実施を行った結果、青色のコロニーが確認されたシャーレが確認されたため、上から1枚目と2枚目の画像を黄色ブドウ球菌「陽性」と判断致しました。そのすぐ後に、栄研化学株式会社で販売している黄色ブドウ球菌鑑別用「PSラテックス」を実施し、陽性反応が示されるか確かめようとしましたが、「陰性」反応を示しました。 画像3枚目は青色発色が弱く、表皮ブドウ球菌だと確信し「陰性」と判断致しましたが、画像1枚目と2枚目の青く反応したシャーレについては「陽性」と判断しても良いのでしょうか?ご回答、宜しくお願い申し上げます。
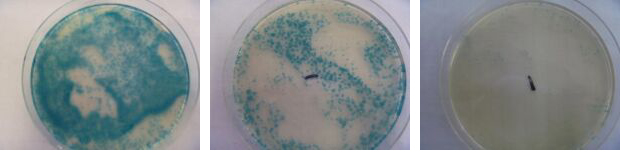
さて、今回ご相談させて頂きたい件が御座いまして、ご連絡させて頂きました。 先週末から、X-SA寒天培地の使用を本格的に実施しておりますが、扱い慣れていない酵素基質培地の特性や、判定基準について戸惑いを感じております。是非、判定方法について助言を頂きたいと思いまして、ご連絡致しました。 添付した写真は、27日に製品検査を実施し、正午頃(12時)から、孵卵器内にて24時間培養を行い、28日の正午頃(12時)に確認した、3検体分・3種類のシャーレ画像です。 X-SAの作製手順に従い、実施を行った結果、青色のコロニーが確認されたシャーレが確認されたため、上から1枚目と2枚目の画像を黄色ブドウ球菌「陽性」と判断致しました。そのすぐ後に、栄研化学株式会社で販売している黄色ブドウ球菌鑑別用「PSラテックス」を実施し、陽性反応が示されるか確かめようとしましたが、「陰性」反応を示しました。 画像3枚目は青色発色が弱く、表皮ブドウ球菌だと確信し「陰性」と判断致しましたが、画像1枚目と2枚目の青く反応したシャーレについては「陽性」と判断しても良いのでしょうか?ご回答、宜しくお願い申し上げます。

X-VP寒天培地を用いた腸炎ビブリオの判定方法 X-VP寒天培地を用いた腸炎ビブリオの判定方法について質問です。 海水をX-VP培地に塗抹して20時間培養したところ、中心が薄い緑色を呈する白色コロニーがあり判別に迷っております。後ほど写真をメールにて添付しますのでご確認お願いいたします。
XM-G寒天での大腸菌群数は赤と青のコロニーの合計数か
XM-G寒天培地で大腸菌群および大腸菌の定量を考えています。大腸菌とは別に大腸菌群全体をカウントする場合には赤色コロニーと青色コロニーの合計を出すのでしょうか?大腸菌にもβ-ガラクトシダーゼ活性があるはずですので、この場合どうしたら良いのかご教示ください。
XM-G寒天とBCPプレートカウントアガールの培養時間について
XM-G培地を使い、培養したところ24時間では白いコロニーが検出されてはいましたが、大腸菌群は陰性と判断しました。しかし、さらに24時間培養したところ(合計48時間)そのコロニーが赤く変化しており陽性になっていました。
こんなことはあるのでしょうか?これは大腸菌群なんでしょうか?
乳酸菌の培地で検査をしたところ24時間後にはコロニーの周りも黄色く変化し乳酸菌の検出だと判定いたしました。しかし、48時間後には黄色の培地がものと紫色の培地に戻っていました。
これはどういうことでしょうか?
XM-G寒天培地で中心部のみが赤色のコロニーの判定
大腸菌群の判定について
XM-G寒天培地にて大腸菌、大腸菌群の判定を行なっています。
ピンクまたは赤色のコロニーを大腸菌以外の大腸菌群と判定しておりますが、中心部が赤色で、まわりが白色のコロニーはどのように判定したらよいでしょうか?
XM-G寒天培地における大腸菌群数の解釈
大腸菌は大腸菌群のカテゴリーに含まれるものであると認識しているのですが、大腸菌群数を計数する際、赤色のコロニーの数と青色のコロニーの数を足すべきなのか、それとも、大腸菌群数=赤色のコロニー数なのか判断に困っております。
大腸菌は大腸菌群のカテゴリーに含まれるものであると認識しているのですが、大腸菌群数を計数する際、赤色のコロニーの数と青色のコロニーの数を足すべきなのか、それとも、大腸菌群数=赤色のコロニー数なのか判断に困っております。
XM-G寒天培地の表面がでこぼこになる
X-MG寒天を、混釈平板培養しますが、表面がデコボコして、平らになりません。培地が混ざってないのか、シャーレに流す温度(50℃前後)が悪いのか、原因がわかりません。
ちなみに、標準寒天も同じように作業しますが、特に問題ありません。
XM-G寒天培地の重層の必要性
XM-G培地での分析手順
とても基本的な質問ですが、XM-G培地にて大腸菌群の分析をする場合は、混釈培養する場合、重層したほうが良いのでしょうか?
YM寒天培地を用いた耐糖性酵母の検査
YM寒天培地を使用した耐糖性酵母の検査を行いたいと思いますが培地の調整方法と検査方法を教えて下さい。
YM寒天培地を使用した耐糖性酵母の検査を行いたいと思いますが培地の調整方法と検査方法を教えて下さい。
クロストリジア培地がお茶を接種したら真っ黒になった
クロストリジア培地を使用させていただいておりますが、お茶の菌数を測定しようと接種したところ、培地が一瞬で真っ黒になりました。 なぜそうなるのか知りたいことと(反応など)、回避方法等があるのかご教授いただけたらと思いご連絡致しました。
サルモネラ属菌の検査で発色酵素基質培地を併用
サルモネラ属菌の検査で従来のMLCB寒天培地またはDHL寒天培地に加えて発色酵素基質培地を併用するようにと改正されましたが、どのような理由なのでしょうか。
サルモネラ属菌の検査で従来のMLCB寒天培地またはDHL寒天培地に加えて発色酵素基質培地を併用するようにと改正されましたが、どのような理由なのでしょうか。
ツァペックドックス培地によるAspergillus属、Penicillum属の同定 現在PDAでカビの観察おこなっているのですが、より明解にアスペルギルス属とペニシリウム属の観察をしたいと考えています。ツァペック寒天培地(CZA)が推奨されていますが、ツァペックドックス培地は、組成は違う部分がありますが、同じような目的で使用できる培地と考えてよいのでしょうか? また違う培地でそのような培地があれば教えてください。
デゾキシコレート培地表面に発育したピンク色のコロニーの判定
早速ですが、デソ培地の判定についてお聞きしたいのですが、今回の講習を受けた後から重層せずに1層のみで検査を行なっています。 すると培地の表面に色がピンクのコロニーがでることがあります。(添付書類をご確認ください。) 色のことなので「ここまで」と明確にするのは無理なのかも知れませんが、何か判別方法があれば教えてください。 よろしくおねがい致します。
ブルーライト培地の使用スケール
使用スケール等についてお尋ねいたします。 食品中のE. coliの検査で、EC培地での推定試験の後にブルーライト培地へ接種する際のブルーライト培地のスケール(中試験管で10 mL程度、小試験管で3 mL程度、など)と、EC培地からの接種量(EC培地がfinal 10倍希釈程度なるように、1白金耳程度、など)について教えてください。
使用スケール等についてお尋ねいたします。 食品中のE. coliの検査で、EC培地での推定試験の後にブルーライト培地へ接種する際のブルーライト培地のスケール(中試験管で10 mL程度、小試験管で3 mL程度、など)と、EC培地からの接種量(EC培地がfinal 10倍希釈程度なるように、1白金耳程度、など)について教えてください。
ポテトデキストロース寒天培地上の黒色コロニー
培地はポテトデキストロース寒天培地で、検体は小麦粉です。30℃、5日間培養しました。添付の写真の黒いコロニーをグラム染色したところ、酵母であることがわかりました。グラム染色をする際、糸を引きましたが、特殊なものなのでしょうか?
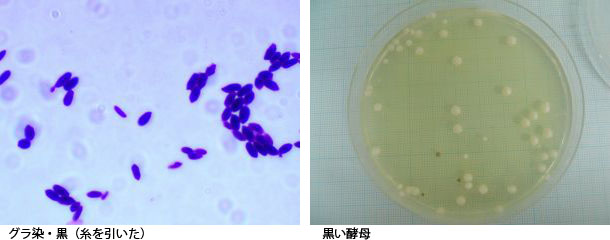
培地はポテトデキストロース寒天培地で、検体は小麦粉です。30℃、5日間培養しました。添付の写真の黒いコロニーをグラム染色したところ、酵母であることがわかりました。グラム染色をする際、糸を引きましたが、特殊なものなのでしょうか?

ラパポート・バシリアディス(RV)培地が変色する機構について
サルモネラの選択増菌培地としてラパポート・バシリアディス培地を使用しています。 緩衝ペプトン水での前増菌培養液を1ml接種した後18時間培養すると何らかの細菌が増殖して?濃緑青色が白く変色する場合があります。どのような機構で白く変色するのでしょうか教えてください。マラカイトグリーンはpHの変化で白変色する色素なのでしょうか?
一般生菌数の検査におけるシャーレの集落数を数えることの 推奨理由
一般生菌数の検査で30~300個の集落が出現したシャーレの集落数を数えることが薦められていますが、どのような理由があるのでしょうか。
乳酸菌数測定用培地
食品中の全ての乳酸菌数(ホモ型、ヘテロ型含む)を網羅的に知る培地を探しております。適切だと考えられる培地をお教え頂ければ幸いです。 現在はBCP加プレートカウント培地を検討しておりますが、その他にお勧めの培地、もしくは複数の培地を組み合わせる方法等ございましたら、ご教授下さい。
食品中の全ての乳酸菌数(ホモ型、ヘテロ型含む)を網羅的に知る培地を探しております。適切だと考えられる培地をお教え頂ければ幸いです。 現在はBCP加プレートカウント培地を検討しておりますが、その他にお勧めの培地、もしくは複数の培地を組み合わせる方法等ございましたら、ご教授下さい。
培地の加温溶解について
私の職場では培地の加温溶解にオートクレーブを使用しています。
デソキシコレート培地の注意などを見ると加温をし過ぎると培養に支障をきたすと記載されていますが、オートクレーブで100℃30分の加温は適切でしょうか?
培地の培養温度の違いについて
SPC、DESO培地の培養温度についてお問い合わせします。
培地の説明書では、培養温度35℃±1℃ですが、乳等省令では32℃~35℃になっています。この違いはどういう理由からなのでしょうか?お教えいただければ幸いです。
変法TGC培地の接種法
変法TGC培地への摂取方法について質問です。
変法TGC培地を入れた試験管へ検体を摂取する際、今までは液面より上から摂取をして、培地と検体を混ぜていましたが、底部から引き上げるように摂取する方法があることを最近知りました。
好気生と嫌気性、どちらの菌も見る目的で使用していますが、今までの摂取方法でも良いのでしょうか?教えてください。
特にきちんとした書類での引継ぎをされてきたものではないため、自分達が誤っている可能性があると思っています。また、この培地は寒天を加えたり、流動パラフィンを重ねる場合などありますが、全て同じ方法で摂取していました。
大腸菌群用培地における培養時間延長時の注意点
御社のX-GAL培地、デソキシコーレイト培地を使用しています。 上記の培地は、22時間以上培養すると大腸菌群以外の菌が検出されてしまいますか? 仮に、培養時間を延長した場合の注意点等がありましたら、教えていただきたいです。
従来法とブルーライト培地の結果食い違い
大腸菌群の判定について、質問があります。
デソキシレート培地にて赤いコロニーが検出され、BGLB培地にてガス陽性反応があるもの関わらず、ブルーライト培地で培養しても、無色透明もしくは白濁している場合があります。なぜでしょうか?
また、この白濁したブルーライト培地を過培養(35℃2日以上)した場合、ピンク色から赤紫色になりました。大腸菌群の判定はどのようにすればよいでしょうか?
検体の希釈水には3種類の組成のものがありますが、これらの特徴とどのように使い 分けをするのでしょうか。
標準寒天で培養延長により検出される菌について
標準寒天培地で一般生菌数をカウントする場合ですが、当社では基本は24時間後の菌数をカウントして、それを一般生菌数としています。
しかしながら、当工場で生産している一部の製品において、24時間~48時間くらいまでであれば、全くでなかったコロニーが、培養時間が長くなると出ることがあります。
製品は、焼成後に冷凍された、加熱済みのレンジタイプのお好み焼です。通常は、一般生菌数は0です。
同じようなたこ焼も製造しているのですが、たこ焼ではそのような現象は見られません。 このお好み焼に限り、培養時間の延長に伴い、コロニーが出ます。大体2乗くらいです。 同時に培養する、その他の未加熱品でも、培養時間延長によるコロニーの増加は見られません。この現象について、おしえていただければと思っております。
標準寒天とSCD(TSA)培地との結果の違いについて
1. 一般生菌数測定用のアキュディア 標準寒天培地 顆粒と、SCD(TSA)培地を1日培養した結果は同等でしょうか?
2. 標準寒天培地は、35℃±1℃で48±3時間培養の場合と22~26時間培養の場合では、結果は異なりますか?上水試験方法に準拠して試験をする場合は、35℃±1℃で22~26時間培養のため気になりました。
1. 一般生菌数測定用のアキュディア 標準寒天培地 顆粒と、SCD(TSA)培地を1日培養した結果は同等でしょうか?
2. 標準寒天培地は、35℃±1℃で48±3時間培養の場合と22~26時間培養の場合では、結果は異なりますか?上水試験方法に準拠して試験をする場合は、35℃±1℃で22~26時間培養のため気になりました。
標準寒天に発育した黒いコロニー
標準寒天培地に黒いコロニーが出ました。 検体は未加熱の鶏ムネ肉です。初めて見る色ですが、この黒いコロニーは一体なんでしょうか?。写真を添付致しますので、ご返答の程よろしくお願い致します。

標準寒天培地に黒いコロニーが出ました。 検体は未加熱の鶏ムネ肉です。初めて見る色ですが、この黒いコロニーは一体なんでしょうか?。写真を添付致しますので、ご返答の程よろしくお願い致します。

分画培地・生培地
アキュレート XM-EHEC寒天培地で青いコロニーとなるO26以外の菌はありますか。他社の微生物同定装置では大腸菌と同定されました。給食従事者の検便検体です。無症状ですが、休ませた方が良いですか?
O26以外では、E. cloacaeなどが紫色コロニーを示す場合があります。同定菌名の確認が必要です。
EHECの場合は、無症状病原体保有者でも、感染症法上、分離・同定による病原体の検出、かつ、分離菌における次の(1)、(2)いずれかによりベロ毒素が確認された場合、届出を直ちに行わなければなりません。(国立感染症研究所 腸管出血性大腸菌(EHEC)検査・診断マニュアル に検査方法など詳細が記載されておりますので、ご参照ください。)
(1) 毒素産生の確認
(2) PCR法等による毒素遺伝子の検出
また、厚労省Q&Aに『症状がないにもかかわらずベロ毒素を産生する菌であることが確認された場合、こうした人を「無症状病原体保有者」といい、本人に症状がなくても、他の人にうつす可能性があります。そのため、感染症の法律上は、患者と同様に便の検査でベロ毒素産生菌が陰性になるまでの間は飲食物の製造や飲食物に直接接触するような業務につくことが制限されます。 なお、自然に菌が陰性化することもあり、引き続き便の検査を受けて菌が便中にいなくなったかどうかを観察する必要があります。また、抗菌剤を使って治療することも菌の陰性化に有効ですが、これらも含めて診断した医師とよく相談して対応を決めることが大切です。』と記載されております。
参考リンク:国立感染症研究所 病原体検出マニュアル-腸管出血性大腸菌(EHEC)検査・診断マニュアル
レジオネラ検査用培地の”GVPC”と”BCYEα”のそれぞれの意味を教えてください。
”GVPC”は、グリシンーバンコマイシンーポリミキシンBーシクロヘキシミド 寒天 の略です。
”BCYEα”は、 Buffered Charcoal-Yeast Extract -αKetogluconate 寒天 の略です。
アルファは、αケトグルタル酸です。
カンピロバクターの第一選択培地はmCCDAとなっていますが、第二選択培地にアキュレート 変法スキロー寒天培地EX(製品コード:51023)を使用してもよいですか?
アキュレート 変法スキロー寒天培地EX(製品コード:51023)は、カンピロバクターの第二選択培地に使用できます。
常温保存培地の保管温度について確認したい。常温保存として2~25℃と書かれていますが、製品を保管している温度が4~10℃となっています。保管温度はどちらですか?
常温保存培地の保管温度は2~25℃です。商品の品質保持のため、弊社のL-センターにて保管している温度は4~10℃です。発送先の代理店での保管温度も4~10℃で保管しております。
嫌気培養用生培地は保存も嫌気状態にするのですか?
使いきりが基本ですが、保管する場合は脱酸素剤を別途用意しておいて、リシールして保管するなど嫌気状態にしてください。
セレウス菌用生培地は島津ダイアグノスティクスで販売されていますか?
申し訳ございませんが、90mmシャーレの生培地はご用意しておりません。
セレウス菌用の調製不要の培地としては、
フードスタンプ セレウス寒天は30枚包装(製品コード:06753)と100枚包装(製品コード:06752)があります。
コンパクトドライ BCは40枚包装(製品コード:06533)と240枚包装(製品コード:06534)がございます。
生培地使用において、使用する生培地の使用期限は、試験を開始した日が期限内であれば(試験が終了した時切れていても)有効と考えてよいでしょうか?
試験を開始した日が使用期限内であれば有効です。 使用期限内の製品について培養を開始して(終了時ではなく)性能評価をしています。
セレウス菌検査における増菌法の必要性について
「セレウス菌」の検査を定性法で実施しようと考えています。定性法でも「直接法」と「増菌法」の2種類あるようですが、どちらの検査方法で実施すればよいのか迷っています。「直接法」の方が判定までにかかる時間が短く、簡単なのですがサルモネラ検査のように増菌して塗抹したほうが確実な結果が出るというようなことはあるのでしょうか。検体によって直接法と増菌法を使い分ける必要はありますか。
「セレウス菌」の検査を定性法で実施しようと考えています。定性法でも「直接法」と「増菌法」の2種類あるようですが、どちらの検査方法で実施すればよいのか迷っています。「直接法」の方が判定までにかかる時間が短く、簡単なのですがサルモネラ検査のように増菌して塗抹したほうが確実な結果が出るというようなことはあるのでしょうか。検体によって直接法と増菌法を使い分ける必要はありますか。
ヘリコバクター寒天培地の特異性について
胃粘膜のホモジネートサンプルを用いて培養した場合にヘリコバクター属の着色したコロニーが発育するとのことですが、もしヘリコバクター属細菌以外の細菌(口腔内常在菌、乳酸菌など)が発育した場合には、着色しないのでしょうか?着色原理がヘリコバクター属細菌に対して特異的なのかどうかを教えてください。
胃粘膜のホモジネートサンプルを用いて培養した場合にヘリコバクター属の着色したコロニーが発育するとのことですが、もしヘリコバクター属細菌以外の細菌(口腔内常在菌、乳酸菌など)が発育した場合には、着色しないのでしょうか?着色原理がヘリコバクター属細菌に対して特異的なのかどうかを教えてください。
ベアード・パーカー(Baird-Parker)寒天培地について
黄色ブドウ球菌の検査では「食安発0729第4号 平成27年7月29日」にてベアード・パーカー(Baird-Parker)寒天培地が指定されましたが、どのような培地なのでしょうか。
黄色ブドウ球菌の検査では「食安発0729第4号 平成27年7月29日」にてベアード・パーカー(Baird-Parker)寒天培地が指定されましたが、どのような培地なのでしょうか。
簡易培地(コンパクトドライ)
工場のラインのふき取り検査を行いたいので、簡単にできる大腸菌群のふき取り検査法を教えてください。
コンパクトドライEC(製品コード:06742、06743)、簡易ふき取りキット(製品コード:06544、06545)を使用すれば、簡単にラインのふき取り検査が出来ます。
ふき取る範囲は100cm²で、ふき取り枠100(製品コード:06598)を使うと便利です。ふき取り液をコンパクトドライECに接種・培養し、大腸菌は青色コロニーを、大腸菌群は、赤色と赤紫色コロニーの合計数を測定して菌数を算出します。
コンパクトドライ SL(製品コード:06732,06733)と一緒に他の大腸菌群用などの培地を培養しても問題はないですか?
一緒に同じふらん器で培養することはできません。コンパクトドライSLの培養温度は42±1℃です。大腸菌群用のコンパクトドライであるEC および CFは35±1℃培養です。
コンパクトドライTCとTCRの比較データはありますか?
コンパクトドライVP(製品コード:06748,06749)にて海水中のビブリオを検出したいのですが、前増菌には何を使えばよいでしょうか?
通知法上の増菌培地にはアルカリペプトン水が指定されていますが、コンパクトドドライ VPは、1プレートあたり10⁴CFU以上の菌が接種されるとコロニー化しないため陽性陰性の判定がしづらくなるため、増菌培養液を1mL接種しての検査はご案内しておりません。増菌培養せずに、直接接種してコロニーを確認する方法もしくは増菌培養したアルカリペプトン水の表層部の1白金耳を画線塗抹する方法で検出してください。
コンパクトドライ X-SA(製品コード:06729,06730)に発育したコロニーを直接用いてラテックス凝集試験を行うことができますか?
当該ラテックス凝集試薬の使用説明書にもよりますが、通知法におけるコアグラーゼ試験の記載では「非選択性のトリプトケースソイ寒天(TSA)培地に塗抹、純培養を行う」とありますので、これに従ってください。 細菌の鑑別試験においては、菌の性状や活性を戻す目的で選択培地から釣菌した後、非選択培地で純培養した菌を用います。
コンパクトドライ EC(製品コード:06742,06743)を使用して、メンブランフィルター法は実施可能でしょうか?フィルター径は47mmです。
コンパクトドライECに精製水又は生理食塩水1mLを予め入れて培地を完成させます。この上にメンブランフィルターをセットして培養する事ができます。コンパクトドライの直径は約50mmですので、フィルターは収まります。
参考リンク:注目製品紹介「コンパクトドライ」ページ
落下細菌検査は、コンパクトドライを用いて実施可能でしょうか?
衛生規範に落下菌の検査方法が書かれていますので、それを参考に、コンパクトドライTCは5分間、YMは20分間放置してから、滅菌生理食塩水を1mL注ぎ、培養します。
参考リンク:注目製品紹介「コンパクトドライ」ページ
コンパクトドライを使用した検査方法は何法と言えばよいですか?
食品衛生検査指針微生物編2018にコンパクトドライを指して「乾式簡易培地」の記載がありますので、これを引用して「乾式簡易培地法」と表記してください。
コンパクトドライの組成を可能であれば教えてください。
コンパクトドライの組成につきまして、下記以外の詳細は非公開とさせていただいております。
・TCは、標準寒天培地をベースに、酸化還元系発色指示薬テトラゾリウム塩;TTC(2,3,5-トリフェニルテトラゾリウムクロライド)を加え、集落を発色させています。
・ECは、MAGENTA-GALおよびX-GLUの2種類の発色酵素基質が培地中に含まれており、大腸菌は青~青紫色、大腸菌群はピンク~赤紫色に発色します。
・CFは、発色酵素基質X-GALが培地中に含まれており、大腸菌群は青~青緑色に発色します。
・YMは、クロラムフェニコールを添加したポテトデキストロース寒天培地をベースに、発色酵素基質(X-Phos)を加えています。
・YMRは、コンパクトドライYMの組成をベースに発育性を改善しています。
・X-SAは、発色酵素基質が培地中に含まれており,黄色ブドウ球菌は直径1~2 mm の水色~青色に発色したコロニーを形成します。
・SLは、乳糖、白糖を含むサルモネラ選択培地組成をベースに、発色酵素基質、ノボビオシン等の選択剤を加えています。
・BCは、発色酵素基質が培地中に含まれており、セレウス菌は青~淡青色に発色したコロニーを形成します。
・VPは、発色酵素基質が培地中に含まれており、腸炎ビブリオは青色に、V.vulnificus、V.cholerae、V.mimicus は淡桃色~赤紫色に発色します。
・ETBは、pH指示薬が培地中に含まれており、腸内細菌科菌群は直径1~2 mmの赤~赤紫色に発色します。
・LMは、発色酵素基質を培地中に含んでいます。
コンパクトドライの国際認証データはどこで得られますか?
国際認証機関の各Webサイトから入手できます。
MicroVal
https://microval.org/en/issued-certificates/
Alternative methods とクリックするとリストが表示されます。
NordVal
https://www.nmkl.org/nordval-international/issued-certificates/
NORDVAL CERTIFICATES の検査対象菌種をクリックしてください。
AOAC-PTM
https://members.aoac.org/AOAC/RI/PTM_Validated_Methods.aspx
Kit Name Contains に「Compact」を入力するなどして検索してください。
コンパクトドライ廃棄時の滅菌時間は20分必要ですか?
滅菌を確実に行うため十分な時間である20分間をお勧めしています。 微生物が殺滅する温度と時間は121℃15分とされており、基本的にはこの温度と時間が中心部まで到達していることをバリデートしていれば121℃15分で問題ありません。なお、ISO 7218では121℃30分が推奨されているようです。
コンパクトドライBCの包装、保存方法
コンパクトドライBC(セレウス菌用)について、最小包装単位と開封前および開封後の保存方法、使用期限の目安について教えてください。
1)包装が40枚とありますが、40枚/袋ですか
2)開封前、室温1~30℃での保存で1年間とありますが、冷蔵庫での保存はできますか。
3)他のQ&AでコンパクトドライVP(腸炎ビブリオ用)の培地が開封3ヶ月程度で変色があったと記載がありました。コンパクトドライBCの開封後の保存方法、使用期限の目安を教えてください。
コンパクトドライBC(セレウス菌用)について、最小包装単位と開封前および開封後の保存方法、使用期限の目安について教えてください。
1)包装が40枚とありますが、40枚/袋ですか
2)開封前、室温1~30℃での保存で1年間とありますが、冷蔵庫での保存はできますか。
3)他のQ&AでコンパクトドライVP(腸炎ビブリオ用)の培地が開封3ヶ月程度で変色があったと記載がありました。コンパクトドライBCの開封後の保存方法、使用期限の目安を教えてください。
コンパクトドライX-SA上で縁が青いコロニーの判定について教えてください。
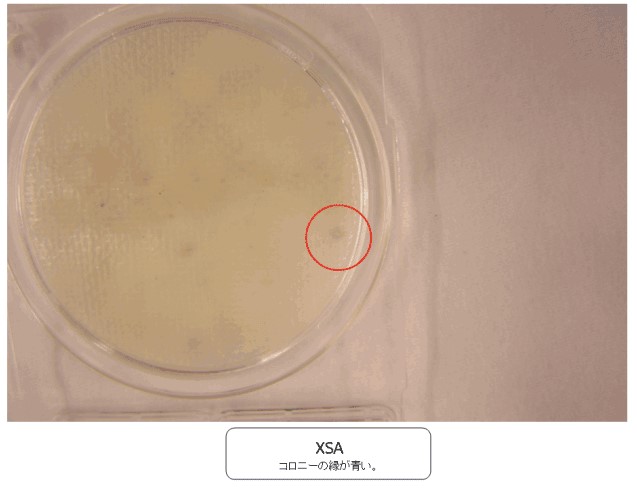

コンパクトドライX-SA上の黄色ブドウ球菌以外のコロニー性状
コンパクトドライX-SA上に発育する黄色ブドウ球菌以外の菌はどんなものがありますか?また、特にBacillus属については、取扱説明書に「一部のBacillus属菌で水色~青色の発色が認められることがありますが,本培地上ではその発色は弱く,摺りガラス状の比較的大きく扁平なコロニーを形成するため鑑別は容易です。」とありますが、発育した写真はありますか?
コンパクトドライX-SA上に発育する黄色ブドウ球菌以外の菌はどんなものがありますか?また、特にBacillus属については、取扱説明書に「一部のBacillus属菌で水色~青色の発色が認められることがありますが,本培地上ではその発色は弱く,摺りガラス状の比較的大きく扁平なコロニーを形成するため鑑別は容易です。」とありますが、発育した写真はありますか?
コンパクトドライYM上の青色の微小コロニーのカウントについて
コンパクトドライYMを使って酵母・真菌数を測定しています。 ある検体を加熱せずコンパクトドライYMに接種すると、大きい青いコロニーが発育し、その数は数百万CFU/gでした。 この検体を80℃、30分加熱した後に測定すると、大きい青いコロニーは現れず、非常に小さい青いコロニー(0.1 mmぐらいの大きさ)が現れ、ルーペを使ってカウントしたところその数は数十CFU/gでした。上記のような非常に小さいコロニーも生菌数としてカウントしていますが、問題ないでしょうか。
コンパクトドライYMを使って酵母・真菌数を測定しています。 ある検体を加熱せずコンパクトドライYMに接種すると、大きい青いコロニーが発育し、その数は数百万CFU/gでした。 この検体を80℃、30分加熱した後に測定すると、大きい青いコロニーは現れず、非常に小さい青いコロニー(0.1 mmぐらいの大きさ)が現れ、ルーペを使ってカウントしたところその数は数十CFU/gでした。上記のような非常に小さいコロニーも生菌数としてカウントしていますが、問題ないでしょうか。
コンパクトドライでの画線培養、コアグラーゼ試験等
コンパクトドライX-SAの使用方法について教えてください。
(1) 培養液を1白金耳量画線する使い方は間違いでしょうか。培地を購入して画線法を採用したいと思います。
(2) コンパクトドライX-SAで検出された集落を直接コアグラーゼ試験に用いる操作は間違いでしょうか。
コンパクトドライX-SAの使用方法について教えてください。
(1) 培養液を1白金耳量画線する使い方は間違いでしょうか。培地を購入して画線法を採用したいと思います。
(2) コンパクトドライX-SAで検出された集落を直接コアグラーゼ試験に用いる操作は間違いでしょうか。
コンパクトドライを使った落下菌測定法
食品工場での落下菌測定についての質問です。現在は、標準寒天培地のシャーレを測定場所に開放放置して測定していますが、コンパクトドライを使用することも可能でしょうか。
食品工場での落下菌測定についての質問です。現在は、標準寒天培地のシャーレを測定場所に開放放置して測定していますが、コンパクトドライを使用することも可能でしょうか。
コンパクトドライ開封後の保存
コンパクトドライVP(腸炎ビブリオ用)のについての質問です。
アルミ袋を開封して培地を使用し、余りは袋の口を丸めセロハンテープでとめて室温で保管していました。 約3ヶ月後にその袋の培地を見ると黄色に変色していました。このような培地は使用できるのでしょうか。
コンパクトドライVP(腸炎ビブリオ用)のについての質問です。
アルミ袋を開封して培地を使用し、余りは袋の口を丸めセロハンテープでとめて室温で保管していました。 約3ヶ月後にその袋の培地を見ると黄色に変色していました。このような培地は使用できるのでしょうか。
コンパクトドライTCで広がったコロニーの判定方法
コンパクトドライTCで判断に困る結果がありました。
1.培養したプレートの培地全体がピンクがかってしまった。コロニーは赤い点になって現れているものもあるが、ピンクの部分をどう判断するかがわからない。 説明書には「菌数が多い場合は、培地全体が着色したようになる」との記載があり、こちらのケースではないかとも考えたのですが、よくわかりませんでした。
2.培地全体がピンクがかっている上に、小さい赤い点が無数に出ていた。 こちらの場合は、菌数が多すぎて赤い小さな点になったのだと考えたのですが、合っておりますでしょうか?
3.また、培地上で、赤い点になっている部分はカウントできるのですが、一部分だけに赤が広がっている状態が培地上に数個見受けられました。 こちらは、一塊りにつき菌数ひとつとしてカウントして良いのでしょうか?
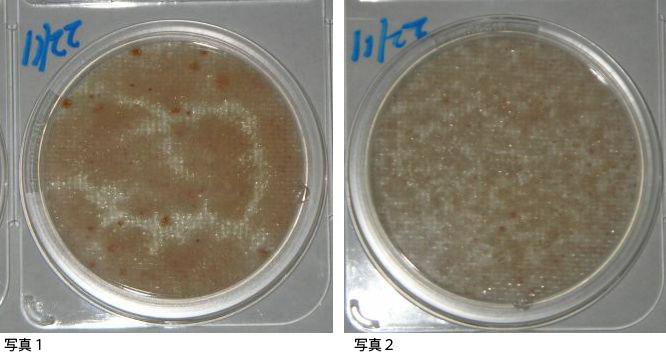
コンパクトドライTCで判断に困る結果がありました。
1.培養したプレートの培地全体がピンクがかってしまった。コロニーは赤い点になって現れているものもあるが、ピンクの部分をどう判断するかがわからない。 説明書には「菌数が多い場合は、培地全体が着色したようになる」との記載があり、こちらのケースではないかとも考えたのですが、よくわかりませんでした。
2.培地全体がピンクがかっている上に、小さい赤い点が無数に出ていた。 こちらの場合は、菌数が多すぎて赤い小さな点になったのだと考えたのですが、合っておりますでしょうか?
3.また、培地上で、赤い点になっている部分はカウントできるのですが、一部分だけに赤が広がっている状態が培地上に数個見受けられました。 こちらは、一塊りにつき菌数ひとつとしてカウントして良いのでしょうか?

コンパクトドライX-SAの原理、マンニット食塩との相関性について
現在は顆粒300 gのマンニット食塩培地に無菌卵黄液を入れ、調製し使用しております。 この調製に時間を要する為に、調製済みの培地への変更を検討しております。 御社のコンパクトドライを検討しておりますが、「原理、結果の相関性」等マンニット食塩培地との違いについて教えてください。
現在は顆粒300 gのマンニット食塩培地に無菌卵黄液を入れ、調製し使用しております。 この調製に時間を要する為に、調製済みの培地への変更を検討しております。 御社のコンパクトドライを検討しておりますが、「原理、結果の相関性」等マンニット食塩培地との違いについて教えてください。
抗菌作用がある検体がコンパクトドライによる検査結果に与える影響
ショウガの抽出エキスパウダーの一般生菌数の検査にコンパクトドライのTCを使用しました。 普段使用している生培地のトリプトソーヤでも同様に試験したところ、異なる結果が出ました。
10倍希釈の検液を0.1 mLトリプトソーヤ生培地に表面塗抹したところ、3~5個のコロニーが検出されましたが、コンパクトドライTCでは10倍、100倍希釈共に、コロニーは検出されませんでした。原因を教えてください。
ショウガの抽出エキスパウダーの一般生菌数の検査にコンパクトドライのTCを使用しました。 普段使用している生培地のトリプトソーヤでも同様に試験したところ、異なる結果が出ました。
10倍希釈の検液を0.1 mLトリプトソーヤ生培地に表面塗抹したところ、3~5個のコロニーが検出されましたが、コンパクトドライTCでは10倍、100倍希釈共に、コロニーは検出されませんでした。原因を教えてください。
腸炎ビブリオ用の緩衝液について
コンパクトドライ VPの取り扱い説明書の操作法の1.に「材料に緩衝液を添加し……」と記載されていますが、「緩衝液」はどのようなものを使えばよいでしょうか?
コンパクトドライ VPの取り扱い説明書の操作法の1.に「材料に緩衝液を添加し……」と記載されていますが、「緩衝液」はどのようなものを使えばよいでしょうか?
水中大腸菌・大腸菌群検査用培地(ECブルー)
ECブルー用のUVランプは取扱説明書には366nmと書いてありますが、365nmのUVランプでもよいでしょうか?
問題ありません。
「水質基準に関する省令の規定に基づき厚生労働大臣が定める方法」や上水試験法にも366nmと書かれています。一般的に理化学検査で使用する長波長の紫外線ランプは365nmとなっているため、よく質問をお受けしますが、ピークが365nmにあるだけで366nmでも十分な線量ですので問題ありません。 なお、使用する紫外線ランプは安価なものは線量が十分でない場合がありますので、理化学検査用のものをご使用ください。
ECブルーを使用しています。いつもは24時間培養後に判定を行っています。
祝日の関係で24時間に判定ができない場合、24時間培養後に冷蔵に温度を落としさらに24時間後に判定しようかと考えていますが、結果に何か影響はありますでしょうか?
祝日の関係で24時間に判定ができない場合、24時間培養後に冷蔵に温度を落としさらに24時間後に判定しようかと考えていますが、結果に何か影響はありますでしょうか?
ECブルーの場合は、水道法で規定された方法に従う事が基本となっておりますので、添付文書で指定している時間内(24~28時間)での判定をお願いいたします。
ECブルーを培養したら白く濁ってしまいました。なぜでしょうか?
上水ではあまり例はありませんが、井戸水などを検査した場合、従属栄養細菌が発育したり、また水質によっては鉱物の濃度が高い場合カルシウムイオンが培地中のリン酸と反応し濁る場合があります。
ECブルーMPNプレートは大腸菌定量検査における簡易方法か
ECブルーMPNプレートは、平成19年に厚労省の通知によるクリプトスポリジウム等指標菌検査の大腸菌定量検査における「簡易方法」でしかないのでしょうか?
ECブルーMPNプレートは、平成19年に厚労省の通知によるクリプトスポリジウム等指標菌検査の大腸菌定量検査における「簡易方法」でしかないのでしょうか?
スタンプ培地(フードスタンプ)
フードスタンプの面積はどの位ですか。もう少し大きめのサイズのSCDLPはありますか。
フードスタンプ、クリーンスタンプの面積は10cm²です。クリーンスタンプ25は25cm²です。クリーンスタンプ25には普通のSCDLP以外に、常温保存可能なガンマ線滅菌の3重包装品もご用意しております。
フードスタンプXM-Gでシンクをスタンプしたが、コロニーがないのに赤く発色した。どう理解したら良いか?
コロニーが認められないとの事ですが、稀に乳酸菌を含む検査対象物では、酵素活性により赤色の発色が認められる事があります。
このような場合は、大腸菌群は陰性判定となりますが、ご心配な場合は、赤い部分を釣菌し、グラム染色するか、別のXM-Gに塗抹し、発色の有無を再確認する事をお勧め致します。
フードスタンプ凍結してしまった。使用してもよいか?
凍結しますと、離水や培地の縮みが認められますので、ご使用は控えてください。
お客様ご自身のご判断でご使用頂く事は可能ですが、弊社としましては使用を推奨いたしません。
フードスタンプTGSE上の黒色コロニー
現在、私どもはフードスタンプ(黄色ブドウ球菌用・TGSE寒天)を用いて、ヒトの皮膚表面に存在する黄色ブドウ球菌を測定しております。その際に、CO2インキュベーターを用いて37℃で約3日間培養しているのですが、形成された黒色コロニーに見本ほどはっきりとした卵黄反応が認められません。これはやはり黄色ブドウ球菌ではないのでしょうか?私どもは表皮ブドウ球菌かもしれないと考えているのですが、もし違うのであれば、どうような菌が考えられるでしょうか?
フードスタンプTGSE寒天の判定方法 TGSE寒天の判定 黒色でコロニー周辺が白濁するとありますが、どの程度のものを黄色ブドウ球菌と判断するのでしょうか?黒色のコロニーは多数発生するのですが判断が出来ませんので詳しくお教えください。写真をいくつか添付いたしますのでよろしくお願いいたします。

フードスタンプ検査後の輸送方法
現場にてフードスタンプを使用し検体採取後、すぐにふ卵器に入れる事が出来ない時の対処方法を教えて頂きたいです。現場までは、発泡スチロールと保冷剤を使用して冷蔵状態に似た状態で持って行くようにしています。 また、採取後に何時間以内にふ卵器に入れて培養するのが好ましいですか。
現場にてフードスタンプを使用し検体採取後、すぐにふ卵器に入れる事が出来ない時の対処方法を教えて頂きたいです。現場までは、発泡スチロールと保冷剤を使用して冷蔵状態に似た状態で持って行くようにしています。 また、採取後に何時間以内にふ卵器に入れて培養するのが好ましいですか。
フードスタンプ標準寒天、TGSE上のコロニーの判定
標準寒天とTGSE寒天で体の各部の細菌検査を行い、そのコロニーの一部を採取しグラム染色をしました。同定検査をし菌を確定すべきところですが、その知識も技術も持ち合わせておりません。コロニーの写真とグラム染色の写真を添付いたしますので、この段階で分かり得る菌の情報を教えてください。 またTGSE寒天で繁殖しました黒色コロニーは周辺部が白濁していることから、黄色ブドウ球菌と判断してよろしいでしょうか。
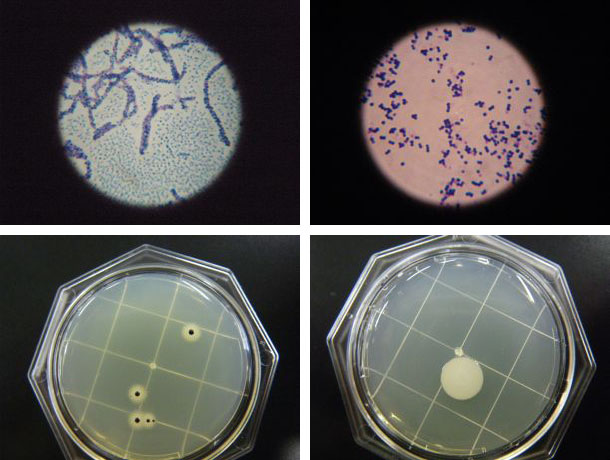
標準寒天とTGSE寒天で体の各部の細菌検査を行い、そのコロニーの一部を採取しグラム染色をしました。同定検査をし菌を確定すべきところですが、その知識も技術も持ち合わせておりません。コロニーの写真とグラム染色の写真を添付いたしますので、この段階で分かり得る菌の情報を教えてください。 またTGSE寒天で繁殖しました黒色コロニーは周辺部が白濁していることから、黄色ブドウ球菌と判断してよろしいでしょうか。

スタンプ培地(クリーンスタンプ)
クリーンスタンプを押し当てた後は、培地成分が付着するので洗うかふき取るかした方が良いですか?
よくふき取るか、洗いによる洗浄をしてください。 接触面にクリーンスタンプの培地成分が残るので、菌の繁殖に適した状態になってしまいます。
クリーンスタンプSCD寒天で真菌数の測定は可能か
クリーンスタンプSCD寒天は名称が一般生菌数測定用となっておりますが、これを用いて細菌+真菌数をまとめて測定することも可能でしょうか?
クリーンスタンプSCD寒天は名称が一般生菌数測定用となっておりますが、これを用いて細菌+真菌数をまとめて測定することも可能でしょうか?
簡易同定キット(IDテスト)・鑑別試験培地
IDテストの判定結果における異常項目の判断基準を教えてください。
同定菌名のテスト項目で陽性率0.20(20%)以下にもかかわらず陽性反応を示した場合、あるいは陽性率0.80(80%)以上にもかかわらず陰性反応を示した場合には、該当するテスト項目は異常項目として項目名の略号が最大3項目まで表示されます。
IDテストの判定結果で、絶対確率と相対確率の意味を教えてください。
既知の菌種に対し、各テスト項目の性状があらかじめ設定されています。それらの性状と未知の菌の性状を照合し、例として既知(+)未知(+)であれば.0.9999、既知(+)、未知(-)であれば、0.0001とします。各同定キットの項目ごとに、これらを掛け合わせたその積が絶対確率となります。(掛け合わせる数値は、項目によって異なります(弊社設定のエラーリスクが考慮されます))。より典型性状に近くなるほど、絶対確率は1に近づきます。相対確率は、複数の候補菌名が得られた場合、それぞれの絶対確率を分子、候補菌名の絶対確率の総和を分母としたときの百分率で表します。
IDテストHN-20ラピッドでは、サイアーマーチン培地から接種は可能ですか?
添付文書において、病原性ナイセリアの迅速スクリーニング(3項目)ではサイアーマーチン培地からの接種は可能となっております。 他の菌も含め同定する場合は、チョコレート寒天培地などの非選択培地から接種をお願い致します。
病原ナイセリアのスクリーニングはIDテストHN-20ラピッドを用いて、PRO、γGA、ONPの3項目にて判定すると添付文書に書かれていますが、どの様に判定したらよいでしょうか?
病原ナイセリアのスクリーニングは、サイアマーチン培地などの病原ナイセリア分離培地に発育した菌についてのみ適用できます。先ず、菌液を分注後プレートにフタをして好気条件下で35~37℃で1時間培養します。次に、1時間培養後プレート上で判定した3項目(PRO、γGA、ONP)の結果を陽性は+、陰性はーと添付の成績表に記入します。3項目の成績を元に、添付文書の10ページにある病原ナイセリアのスクリーニング表にあてはめて判定します。
IDテストEB-20において、コード010433でE. coli inactiveとなりましたがこれは何を意味するのでしょうか。
inactiveは非典型性状を示すE.coliです。運動性陰性のE. coliですが、E. coliと同定して問題ありません。
IDテストHN-20ラピッドのβ-ラクタマーゼの試験法の原理は何ですか?
アシドメトリー法です。ホールにベンジルペニシリンカリウムが入っていて、β-ラクタマーゼにより分解すると、βラクタム環が開裂して、pHが低下します。そこにβ-ラクタマーゼ試薬を添加すると、pH指示薬にて陽性の場合黄変が確認できます。
グラム染色(フェイバーG)
誤嚥性肺炎の判定、疑う場合の報告はどのようにしたらよいですか?
好中球に貪食されたグラム染色像、多くは複数種類の常在菌の貪食像が確認された場合には、「嚥下性肺炎を疑うグラム所見あり」とコメントを入力するとよいと思います。
血液培養で発育した腸球菌と肺炎球菌のグラム染色で、同じに見えてしまいます。コツはありますか?
患者情報から、CRP値が異常高値の場合、肺炎球菌の可能性が高いです。CRPは肺炎球菌が持っているC多糖体に由来します。
グラム染色と検体から推測できない菌が検出された場合、どこまで同定したら良いですか?
検体の種類・品質によってどこまで同定するかは異なると思いますが、無菌材料から検出した場合は起炎菌になりますので、同定が必要となります。ただし、推測できない菌に対し、種々の鑑別試験を行うと時間が掛かってしまい、結局同定できなかったということになりかねません。優先的に薬剤感受検査だけは行います。同定できないことを主治医に説明し納得していただいた場合には、グラム染色性だけでいいのではないでしょうか。もし主治医が感染症の重要な菌と考え、菌種まで同定してほしい依頼した際には、外部に遺伝子学的検査を依頼することになります。
医療改正法に伴い、内部精度管理の実施要項が含まれております。グラム染色の内部精度管理はどのように行えばよいか情報が有ればご教示願います。施設によっては24時間体制で臨床医が行う場合もありますので これら含めて教えて頂ければ幸いです。
日本臨床検査技師会精度管理調査を参考にATCC由来のE. coliとS. aureusで内部精度管理を行うのが一般的によいと思います。フェイバーGの添付文書においても推奨しています。
糞便検体、火炎固定でキャンピロバクターに見えるらせん菌がグラム陽性に染まって見えました。陰性に見えるところもあります。どのように解釈したらよいですか?
グラム陰性菌が陽性に見える場合は、染色液Aの脱色不良が多いですが、しっかり脱色操作をされているということでしたら、火炎固定時の温度が高すぎるかもしれません。
フェイバーGは、毒物・劇物取締法に非該当となっていますが、SDSには施錠保管することと記載されています。 施錠保管が必要な理由を教えてください。
当該製品につきましては、SDSの適用法令欄に記載のあるとおり毒物・劇物取締法の対象外であることは間違いございません。従って、毒物・劇物取締法上の規制として、当該製品に対する法律上の施錠義務はございません。 にも拘わらず保管方法に「施錠」の表記があるのは、当該SDSが、SDS作成を義務づけている関係法令(毒物・劇物取締法、労働安全衛生法、PRTR法)のうち、労働安全衛生法に基づき作成したSDSであり、SDSの記載内容が労働安全衛生法におけるリスクアセスメントの考えに基づき作成している点にございます。
労働安全衛生法におけるリスクアセスメントの考えにつきましては「各事業所においては従業員に対する安全衛生の観点から、職場の潜在的な危険性又は有害性を見つけ出し、これを除去、低減するため手法として労働安全衛生法における事業者の義務」とされています。そこで各事業者においては、職場で使用する試薬類の有害性、安全性に関する情報入手手段としてSDSをご利用されているとの認識から、当社としましては可能な限り有害性、安全性及びこれらのリスク低減の手段をSDSに記載して提供することを旨としております。よって、今回の施錠の表記については、法令上の記載義務というより、「施錠可能な保管場所で保管することが望ましい」という意図で「施錠」という表記を記載しています。
また、SDSの記載内容については国内法令以外にSDSの国際的なルール(GHS)もあり、その中でリスク低減等の記載については、当該製品の使用目的、使用環境等も考慮して可能なリスク低減策を表記することが望ましいとされております。検査に関する専門的な知識を有するお客様の場合、本製品に関して施錠措置まで講じる必要はないと考えられますが、必ずしも専門的知識を有していないお客様の使用も想定されることから、このような表記となっております。
アレルゲン検査(FAテスト、FASTKIT)
イムノクロマト法によるO157簡易検査とVT検査の関連性
現在O-157の検査ではNHイムノクロマトO157を使用し、陽性の場合は酵素基質培地にて確認試験をしています。 しかし、結果がでるのが72時間後と遅い為、NHイムロクロマトO157が陽性の場合は酵素基質培地の代わりにNHイムノクロマトVTで確認すれば良いのではないかと考えました。
ここで3点質問があります。
1. NHイムロクロマトO157で陽性の場合O-157でないという事はありますか?あるとしたらどのような場合なのでしょうか?
2. NHイムノクロマトO157陽性の場合にNHイムノクロマトVTが陰性になる事はありますか?それは、どの様な場合でしょうか?
3. NHイムノクロマトO157陽性でNHイムノクロマトVT陰性の場合にはO-157陰性と判定して良いのでしょうか?
現在O-157の検査ではNHイムノクロマトO157を使用し、陽性の場合は酵素基質培地にて確認試験をしています。 しかし、結果がでるのが72時間後と遅い為、NHイムロクロマトO157が陽性の場合は酵素基質培地の代わりにNHイムノクロマトVTで確認すれば良いのではないかと考えました。
ここで3点質問があります。
1. NHイムロクロマトO157で陽性の場合O-157でないという事はありますか?あるとしたらどのような場合なのでしょうか?
2. NHイムノクロマトO157陽性の場合にNHイムノクロマトVTが陰性になる事はありますか?それは、どの様な場合でしょうか?
3. NHイムノクロマトO157陽性でNHイムノクロマトVT陰性の場合にはO-157陰性と判定して良いのでしょうか?
甲殻類アレルゲンの残存とコンタミについて
弊社サンドイッチ工場においてフライヤーでエビカツを揚げる製品がありますがフライオイル中にアレルゲンが残存するものでしょうか?
また、小さいエビの混入による海苔の扱い等はどうするのでしょうか?
精度管理
BioBallの試験成績書のダウンロード方法を教えてください。
BioBallの試験成績書はビオメリュー社「RESOURCE CENTER」からアカウント登録のうえログインし、ダウンロードしてください。 ログイン方法につきましては、コスモ会のビオメリュー社商品ページから「RESOURCE CENTER簡易使用ガイド」をご覧ください。一度登録すると、次回からはログインボタンを押すだけで試験成績書をダウンロードできる画面に入りますので、ロット番号を入力すればダウンロードできます。
参考:ビオメリュー社商品ページ 各種資料→試験成績書→RESOURCE CENTER簡易使用ガイドが閲覧可能です。
サーベイについてよくあるお問い合わせを教えてください。
サーベイのお申し込み方法とその他のよくあるお問い合わせについては下記URLからご参照ください。
https://industrial-diagnostics.biz.sdc.shimadzu.co.jp/support/survey/guide/#faq
細菌検査精度管理サーベイでのZスコアの解釈について教えてください。
±1 Z スコア以内の場合 非常に良好な結果です。 ±1 Z スコア~± 2 Z スコア以内の場合 ほぼ良好な結果です。検査手技などの問題はありません。 ±2 Z スコアを越えた場合 測定結果が±2 Z スコアの範囲をはずれています。 検査操作全体(操作法・培地調製法など)について検査操作全体(操作法・培地調製法など)について検証する必要があると考えられます。 としています。
内部精度管理方法の例
現在「細菌検査精度管理サーベイ」のような外部精度管理の他に、内部精度管理を実施し、検査レベルの底上げを図りたいという声が上がっています。
内部精度管理に関する製品またはキット等の取扱いはしていますか? なお、社内の検査では一般細菌及び大腸菌群を主な検査項目として実施しています。
現在「細菌検査精度管理サーベイ」のような外部精度管理の他に、内部精度管理を実施し、検査レベルの底上げを図りたいという声が上がっています。
内部精度管理に関する製品またはキット等の取扱いはしていますか? なお、社内の検査では一般細菌及び大腸菌群を主な検査項目として実施しています。
器材
嫌気培養に用いる脱酸素剤に感受性用のものがあるとのことですが、実際にどういうものですか。
当社で販売しているアネロメイトは、三菱ガス化学アネロパック・ケンキ(薬剤感受性用)のガス濃度変化と同様の推移になっております。
その他
Afipia broomeae とBradyrhizobium sp培養方法
Afipia broomeae 及びBradyrhizobium spの分離用培地と培養方法を教えて下さい。 また、これらの菌は一般的にどんな処に存在するのでしょうか。 お忙しい処申し訳ありませんが、宜しくお願い致します。
酢酸菌の培養方法
「酢酸菌」を培養しようと思っているのですが、何も知識が無く、情報も無く困っています。まず、培地はどれを使用したら良いでしょうか? ネットで色々検索していたのですが、「SM培地」にエタノールを添加すると良い いう方法が載っていました。この「SM培地」は調整済みのものが販売されいていますでしょうか?最初から調整しないとダメでしょうか?
「酢酸菌」を培養しようと思っているのですが、何も知識が無く、情報も無く困っています。まず、培地はどれを使用したら良いでしょうか? ネットで色々検索していたのですが、「SM培地」にエタノールを添加すると良い いう方法が載っていました。この「SM培地」は調整済みのものが販売されいていますでしょうか?最初から調整しないとダメでしょうか?
酵母の死滅温度
一般的に酵母菌は、中心温度何度で何分加熱すれば死滅するのでしょうか?
一般的に酵母菌は、中心温度何度で何分加熱すれば死滅するのでしょうか?
醗酵と腐敗
醗酵か腐敗かのように人に有用か有害かのくくりはどこで判断されるのでしょうか。
食品のカビに関する規制
無加熱摂取で乾燥食品などの場合、真菌(カビ)における基準はありますでしょうか。 一般に乾物などは、加熱を行なって食するものなので、ある程度カビが確認されても大丈夫であるとは思いますが、例えば、真菌検査においてカビが確認された場合、菌数の良否基準はありますでしょうか? 真菌の場合、目で見て食材の腐敗状況がわかってしまうかどうかが、判断の際に重要であるとお聞きしたことがあるのですが、目で見てカビを確認することができなくても真菌検査においての真菌の基準のラインをどこで設ければよいのでしょうか。(食べても体に害がないと言えるかどうかのライン)
無加熱摂取で乾燥食品などの場合、真菌(カビ)における基準はありますでしょうか。 一般に乾物などは、加熱を行なって食するものなので、ある程度カビが確認されても大丈夫であるとは思いますが、例えば、真菌検査においてカビが確認された場合、菌数の良否基準はありますでしょうか? 真菌の場合、目で見て食材の腐敗状況がわかってしまうかどうかが、判断の際に重要であるとお聞きしたことがあるのですが、目で見てカビを確認することができなくても真菌検査においての真菌の基準のラインをどこで設ければよいのでしょうか。(食べても体に害がないと言えるかどうかのライン)
食品の微生物検査を実施する際の資格について
食品の微生物検査に関する資格試験などがなにかありましたら教えてください。
食品の微生物検査に関する資格試験などがなにかありましたら教えてください。
食品検査の解説書は?
食品検査の技法を理解するための参考書を探しております。お勧めの書籍がありましたらご紹介してください。
みそ製品中の酵母の測定方法
みそ製品中の酵母の測定方法を教えてください。80℃、4分間の殺菌をしております。殺菌の効果確認(膨張しないこと)のためです。
クロストリジウム属による微生物危害について 自主検査で嫌気性菌の検査としてクロストリジア測定用培地を用いたパウチ法を採用しております。培地容器の側面に、「品質の点でC. bifermentans, C. sporogenes, C. butyricumなどが重要」との記載がございますが、当方にクロストリジウム属に関する資料が乏しく、ウェルシュ、ボツリヌスのほかに品質に関する資料などございましたら、ご紹介いただけますと幸いです。また、同様に魚類に関する嫌気性菌の食中毒および品質事故などございましたら、ご教示いただきたくお願い申し上げます。
クロストリジウム属菌の報告について
クロストリジウム属菌の検査で、褐色~黒いコロニーが検出された場合はその数をカウントしますが、全くコロニーが出ていない場合、「陰性」となるのでしょうか?
教えてください。
コンラージ棒の再使用について
複数種類の平板培地に同一検体を塗抹する場合、同じコンラージ棒で続けて塗抹すると何か支障がありますか? 現在は、各培地に塗抹するたびアルコールに浸け、火炎消毒しています。これを省略できると、時間短縮できるのですが……。
複数種類の平板培地に同一検体を塗抹する場合、同じコンラージ棒で続けて塗抹すると何か支障がありますか? 現在は、各培地に塗抹するたびアルコールに浸け、火炎消毒しています。これを省略できると、時間短縮できるのですが……。
ストマッカー袋へのサンプリング時においての無菌操作
フィルター付きストマフィルターにサンプル10g、滅菌済み0.1%ペプトン加生理食塩水90mlを入れストマッカーにかけるときについて教えて下さい。
弊社では、無菌操作を重視するために上記の作業を含め培地を流し込むまでエアコンをOFFにしてガスバーナーを着火し、空気の流れをコントロールした条件下で検査しています。 査察に行った、会社では、上記の操作はエアコンON、ガスバーナー設置していない(卓上タイプもなし)。検査室は4畳ぐらいのスペースで人の複数で作業しています。シャーレに接種し、培地に流し込む工程は簡易的なクリーンベンチで行う。
そこで、質問ですが、最終的には、求める菌検査のレベル(製品の規格値など)で変わると思うのですが、ストマッカーにかける処理について、エアコンONでガスバーナーの無い環境下でのサンプリングは検査として一般的なの事でしょうか?
もし、良ければ、御社ではどのように行っているか教えていただけると助かります。
ブドウ球菌の種類とコアグラーゼ反応と卵黄反応の関係 食塩卵寒天培地で、黄色ブドウ球菌に似たハローが出ています。 ラテックスで凝集反応は見られず、グラム陽性球菌でした。 このようなコロニーの出方で、考えられる菌種を教えていただければと思います。 わかりにくい写真ではあるかと思いますが、添付ファイルのご確認お願いいたします。
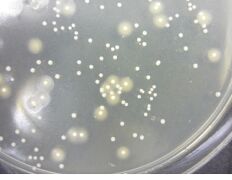

リン酸バッファー原液の保管方法
初歩的な質問ですみません。最近リン酸バッファーを作成し使用するようになったのですが、分からない点があります。
リン酸バッファー原液(滅菌していない)の保管方法を教えて下さい。
褐色瓶に入れ冷蔵保管でよろしいのでしょうか?
(使用量が少ないため、作成量も最小限で作成しております)
この原液の日持ちは、どのくらいでしょうか?
低温細菌の定義と検査
低温細菌について、教えていただきたいのですが、低温細菌の明確な定義はありますでしょうか。 又、低温細菌の検査法としては、食品衛生検査指針では〔標準寒天培地、7±1℃で7日間培養〕となってますが、その他の検査法はありますでしょうか。
又、弊社では10℃のインキュベーターしか空いていないのですが、10℃の場合は何日培養にすればよろしいでしょうか。
菌検査初心者なので、分かりやすく教えていただけると大変助かります。
大腸菌群と大腸菌とE. coliの違い、検査意義
大腸菌群と大腸菌とE. coliの違いを教えてください。 集合で表すと大腸菌群が大きな輪で中に糞便系大腸菌群(E. coli)その輪の中に大腸菌ですか。 食品衛生法での呼び方と細菌学的には違いますか。 食品で食中毒になる大腸菌O-157は、どこになりますか。 大腸菌群や大腸菌、E. coliの検査の意義は何ですか。
大腸菌群と大腸菌とE. coliの違いを教えてください。 集合で表すと大腸菌群が大きな輪で中に糞便系大腸菌群(E. coli)その輪の中に大腸菌ですか。 食品衛生法での呼び方と細菌学的には違いますか。 食品で食中毒になる大腸菌O-157は、どこになりますか。 大腸菌群や大腸菌、E. coliの検査の意義は何ですか。
大腸菌群の検査でデゾキシコレート培地に検体液を混釈接種し、培地固化後に更に培地を注ぎ重層した方がよいと聞きましたが、どのような効果があるのでしょうか。
容器表面の菌数測定のやり方
容器に湿っぽさが残っているものと、乾いているものを比較して雑菌の有意差を確認したい。テスト、及びテスト品の処理までお願いしたいので、ご教示をお願いします。
容器に湿っぽさが残っているものと、乾いているものを比較して雑菌の有意差を確認したい。テスト、及びテスト品の処理までお願いしたいので、ご教示をお願いします。


